Los electrones de los átomos tienen unas determinadas energias que se llaman niveles. Estas energias dependen de la carga del nucleo y del orbital en el que se encuentra ese electron.
Los subniveles se observan al observar mas detenidamente, o por ejemplo, por aplicar campos magnéticos en el átomo. El nivel inicial se desdobla en varios de energías similares, pero no iguales.
Los electrones se colocan en orbitales, cada uno de los cuales pueden contener 2*n^2 electrones (^ significa elevado a), siendo n el nivel (o numero cuantico principal). Por ejemplo, el átomo de carbono tiene 6 electrones, que se colocarían de la siguiente manera: 1s^2 2s^2 2p^2 (aqui ^ significa el numero de ocupacion, los electrones que hay en cada orbital.

niveles de energia: k,l.m,n,o,p y q.
K: Primer nivel: 2 electrones (s =2.
L:Segundo nivel: 8 electrones (s =2,p =6).
M:Tercer nivel: 18 electrones (s =2,p = 6,d =10).
N: Cuarto nivel:32 electrones (s=2,p=6,d=10,f =14).
O:Quinto nivel:32 electrones (s=2,p=6,d=10,f =14).
P:sexto nivel:32 electrones (s=2,p=6,d=10,f =14).
Q:Septimo nivel:32 electrones (s=2,p=6,d=10,f =14).

Hay cuatro subnivele de energia estos son : s,p,d y f.
los orbitales de energía son los que describen el comportamiento ondulatorio que pueden tener los electrones en las moléculas. Estas funciones pueden usarse para calcular propiedades químicas y físicas tales como la probabilidad de encontrar un electrón en una región del espacio. Los orbitales se construyen habitualmente por combinación lineal de orbitales atómicos centrados en cada átomo de la molécula. Utilizando métodos de cálculo de la estructura electrónica.
Niveles de energía y orbitales
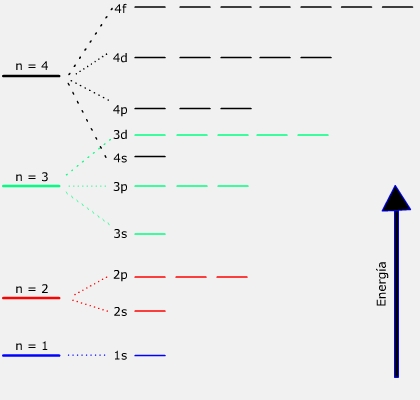
En un átomo los electrones ocuparán orbitales de forma que su energía sea la menor posible. Por ello se ordenan los orbitales en base a su nivel energético creciente.
La energía de los orbitales para átomos de varios electrones viene determinada por los números cuánticos n y l. En la figura de la derecha se muestran los orbitales de los 4 primeros niveles de energía (desde n = 1 hasta n = 4) y su orden de energía. Puede verse que la energía de los orbitales no coincide exactamente con el orden de los niveles. Por ejemplo, el subnivel 4s tiene una menor energía que el 3d.